Completion requirements
View
6. Soluzioni tampone: equilibrio
Chiamiamo Ca e Cb (a = acido; b = base) le concentrazioni iniziali di HA e NaA, e impostiamo il bilancio di massa all’equilibrio di dissociazione di HA in presenza di NaA:
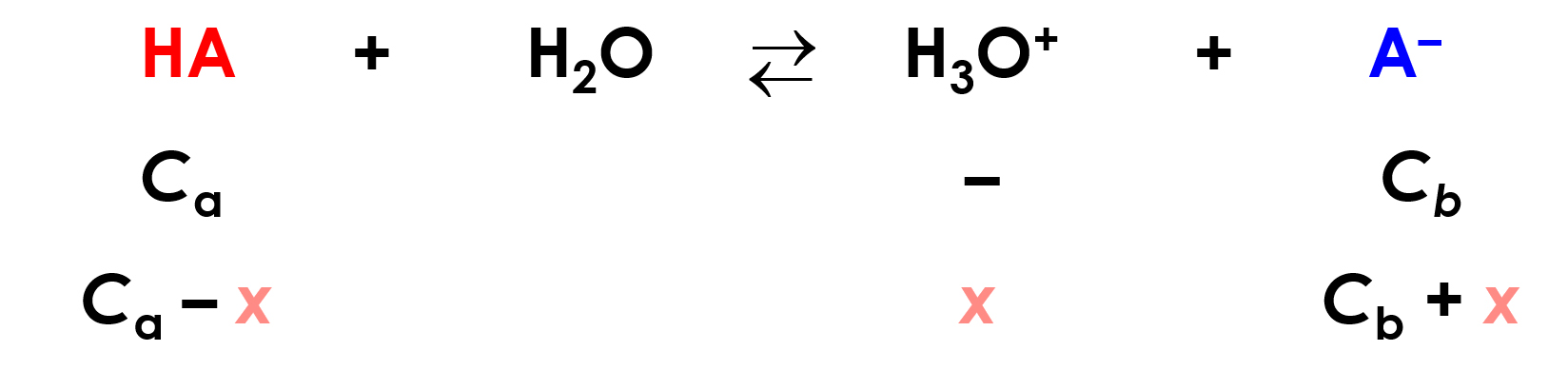
Ma x, che rappresenta la quantità di acido che si è dissociato e quindi la quantità di ioni H3O+ è solitamente trascurabile rispetto a Ca e a Cb, in quanto:
- Ka è piccola (la specie che si dissocia è un acido debole)
- HA, acido debole, è molto poco dissociato perché, per il principio di Le Châtelier, la grande quantità di A– presente in soluzione e che deriva dall’aggiunta in soluzione del sale (sodico) NaA sposta l'equilibrio verso la formazione di HA non dissociato.
\( [HA]=C_a-x ≅ Ca \)
e
\( [A^-]=C_b+ x ≅ C_b \)
da cui
\( K_a=\frac{[H_3O^+][A^-]}{[HA]} ≅\frac{[H_3O^+]C_b}{C_a} \)
Da cui si ricava
\( [H_3O^+]=K_a\frac{[HA]}{[A^-]}≅ K_a \frac{C_a}{C_b} \)
\( pH=pK_a-\frac{C_a}{C_b} \)
