Aggregazione dei criteri
Visualizzare
8. Soluzioni tampone acide (pH < 7)
Per le soluzioni tampone caratterizzate da un pH < 7, risulta Ka(HA) > Kb(A-).
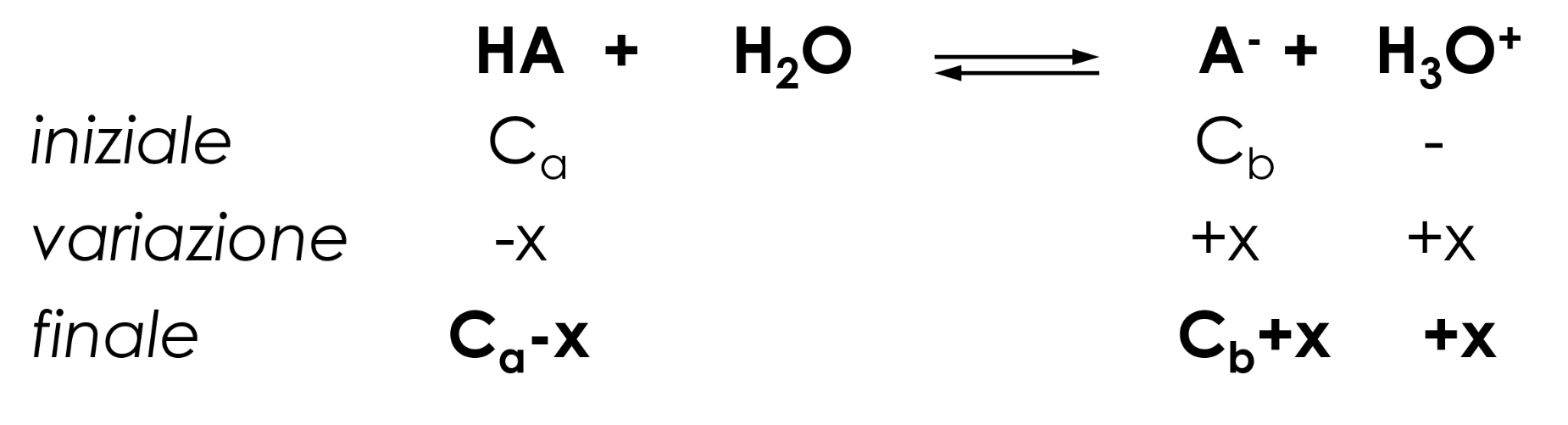
L’equilibrio di dissociazione prevalente da considerare, partendo dalle condizioni iniziali è quello acido:
\( K_a=\frac{[H_3O^+][A^-]}{[HA]} =\frac{[H_3O^+](C_b+x)}{(C_a-x)} ≅ [H_3O^+] \frac{C_b}{C_a}
\)
\( [H_3O^+] =K_a\frac{C_b}{C_a}
\)
il calcolo del pH può avvenire attraverso questa espressione
\( pH = pK_a-log \frac{C_a}{C_b} \)
