Completion requirements
View
1. Disposizione degli elettroni nell’atomo di carbonio
Ogni atomo fa muovere i suoi elettroni all’interno di spazi, chiamati orbitali atomici, aventi distanza dal nucleo, forma ed energia definite e caratteristiche. La collocazione degli elettroni in tali spazi segue delle regole precise:
- Vengono riempiti prima gli spazi (orbitali atomici) più vicini al nucleo, poi via via gli altri.
- Ogni orbitale atomico può essere occupato al massimo da due elettroni, aventi spin opposti.
- In presenza di più orbitali atomici equivalenti (definiti degeneri), gli elettroni si dispongono in maniera da occuparne il maggior numero possibile.
L’atomo di carbonio possiede sei elettroni e cinque differenti orbitali atomici in cui disporli:
- l’orbitale 1s che presenta forma sferica e si trova nel livello 1, a minore distanza dal nucleo e a più bassa energia. Ospita due elettroni, considerati elettroni interni.
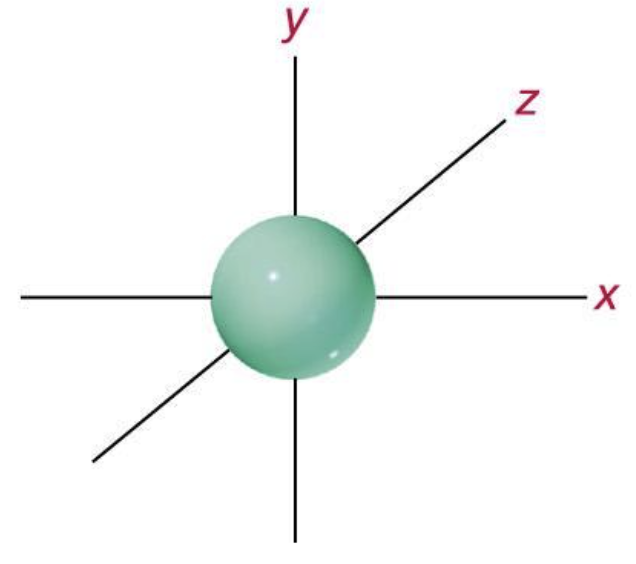
- L’orbitale 2s, anche esso a forma sferica e che si trova nel livello 2, a maggiore distanza dal nucleo ed a più alta energia, ospita due elettroni, considerati elettroni esterni, che si muovono nella parte più esterna della sfera, in quanto la zona interna (detta zona nodale) non può essere occupata sulla base di regole dettate dalla meccanica quantistica.
- gli orbitali 2px, 2py e 2pz, sono tre orbitali degeneri (cioè aventi la stessa energia) a forma di doppio lobo, si trovano nel livello 2, a maggiore distanza dal nucleo ed a più alta energia (superiore all’orbitale 2s), i primi due (2px e 2py) ospitano un elettrone ciascuno, considerati elettroni esterni, il terzo orbitale (2pz) è vuoto.