2. Formazione di legami tra gli atomi
Gli atomi si legano tra loro utilizzando i loro elettroni più esterni (elettroni di valenza).
Per spiegare perché gli atomi formano legami, Lewis propose che: «Un atomo ha la massima stabilità quando il suo livello più esterno è completo e non ha elettroni a energia più alta».
Secondo questa teoria un atomo tende a cedere, acquistare, o condividere elettroni per «completare» il suo livello energetico più esterno e riempire gli spazi (orbitali atomici) di cui dispone. Per fare questo l’atomo di carbonio né cede, né dona i suoi elettroni, ma li condivide. Per tale motivo la maggior parte dei legami nei composti organici si forma attraverso la condivisione di due elettroni tra due atomi: legami covalenti. Lo spazio condiviso formato dalla sovrapposizione di orbitali atomici viene chiamato orbitale molecolare.
Consideriamo ad esempio la formazione della semplice molecola di idrogeno attraverso l’instaurarsi di un legame covalente tra due atomi di idrogeno: in questo caso il legame risulta dalla combinazione di due orbitali atomici 1s per formare un orbitale molecolare σ.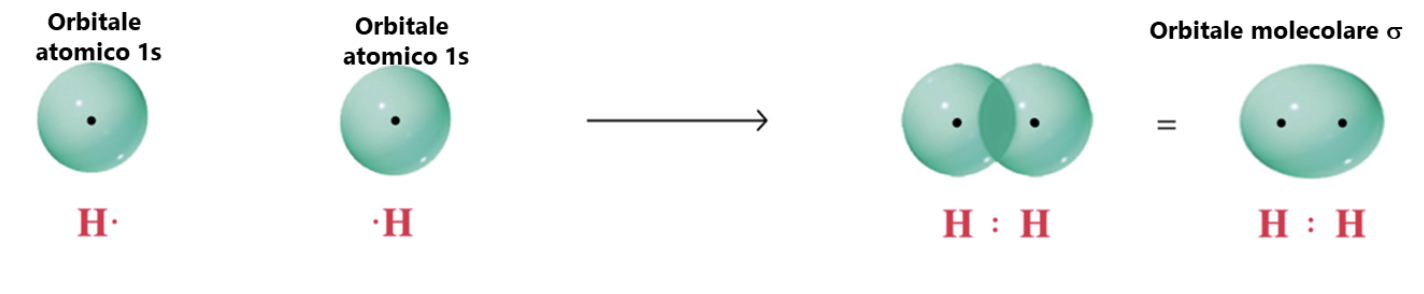

Per questo motivo il carbonio forma quattro legami covalenti, che possono essere 4 legami singoli, 2 legami singoli e 1 legame doppio, 1 legame singolo e 1 legame triplo.
