3. I legami singoli del carbonio
La molecola più semplice in cui riconosciamo un atomo di carbonio impegnato a formare 4 legami covalenti singoli è il metano.
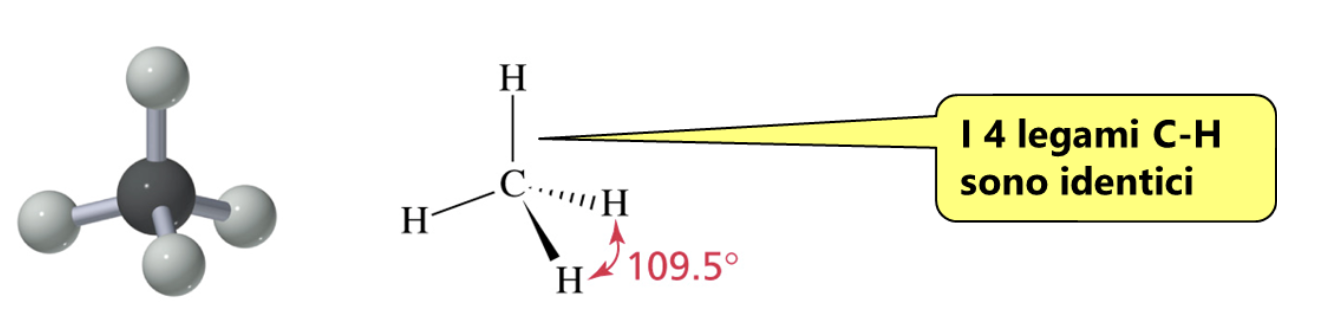
Sperimentalmente si è osservato che i quattro legami carbonio-idrogeno (C-H) sono identici come forza e lunghezza e che il carbonio si dispone al centro e i 4 idrogeni ai vertici di un tetraedro regolare. Come fa il carbonio a formare 4 legami identici utilizzando 4 elettroni esterni che si trovano in orbitali atomici diversi? Per spiegare l’evidenza sperimentale i chimici ricorrono alla Teoria dell’Ibridazione. In pratica si assume che il carbonio “ibridi” i suoi orbitali esterni differenti per numero di elettroni ospitati, forma ed energia (stato fondamentale), trasferendo un elettrone dall’orbitale 2s all’orbitale 2pz vuoto (stato eccitato) e ridistribuendo i 4 elettroni spaiati che così ottiene in 4 orbitali atomici identici per forma ed energia (stato ibridato sp3).
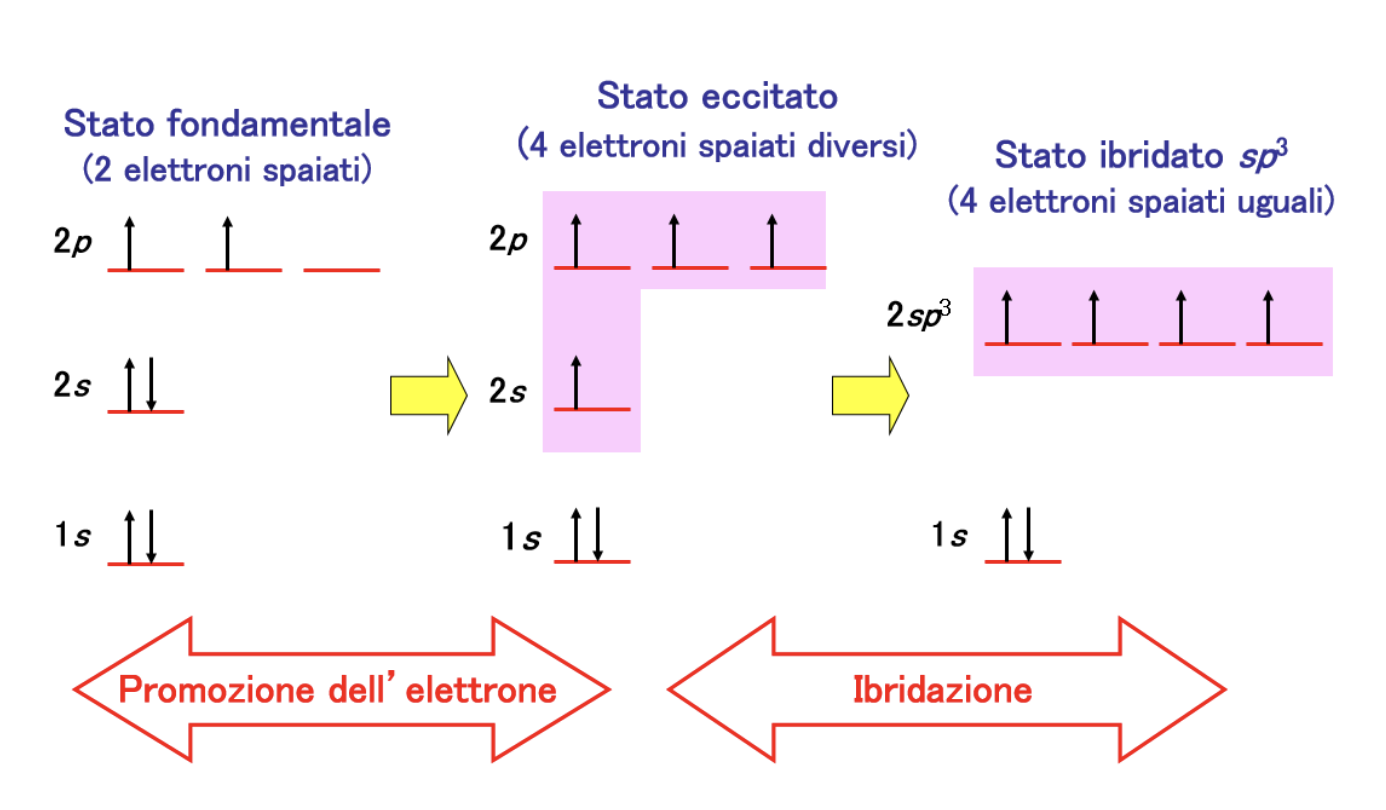
Nella figura è illustrato il processo descritto.
