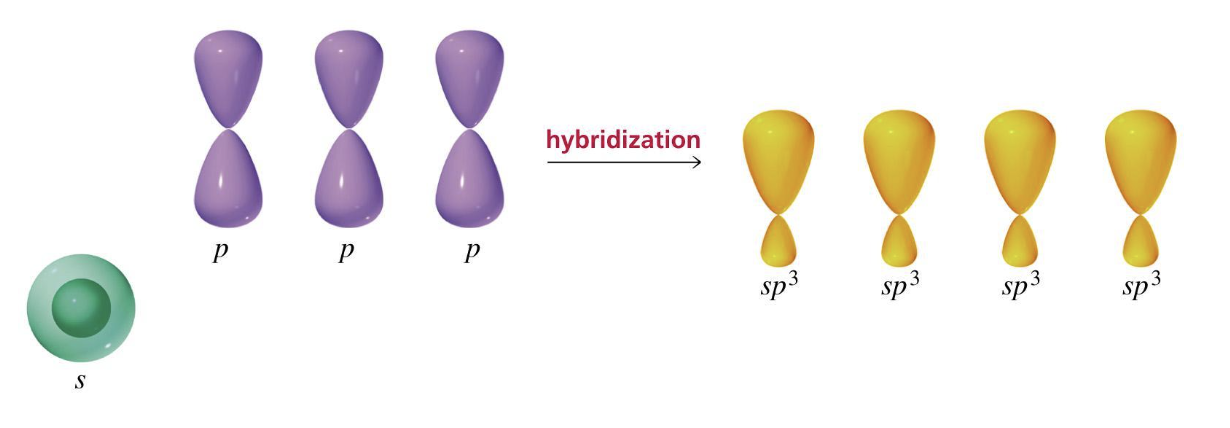
4. Ibridazione sp3 degli orbitali e geometria spaziale
Per rappresentare le regioni spaziali definite dagli orbitali ibridati si ricorre ad una forma intermedia tra quella sferica e quella bilobata: l’orbitale atomico ibridato sp3 presenta due lobi non simmetrici, di cui uno più esteso dell’altro.
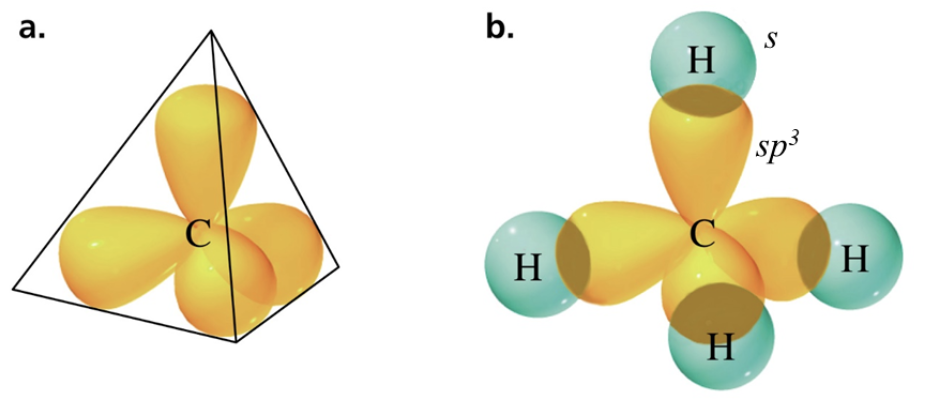
Gli orbitali atomici utilizzati dagli atomi nella formazione dei legami determinano la geometria spaziale della molecola. L’angolo di legame, che è l’angolo avente per vertice il carbonio e per lati gli assi congiungenti i nuclei dei due atomi consecutivi legati, nel carbonio sp3 è: 109.5°.
I 4 atomi legati dal carbonio si dispongono ai vertici di un tetraedro [figura a]. Le coppie di elettroni che formano i legami tra due atomi si dispongono nello spazio in modo da risultare il più lontano possibile per minimizzare la repulsione elettronica. (Secondo la teoria VSEPR: Valence Shell Electron Pair Repulsion, cioè repulsione delle coppie elettroniche nel guscio di valenza)
Nel metano la sovrapposizione tra un orbitale atomico ibridato sp3 del C e un orbitale atomico s di un H genera un orbitale molecolare (o legame) 𝜎. Nel metano il C forma 4 legami σ identici [ figura b] genera un orbitale molecolare (o legame) 𝜎. Nel metano il C forma 4 legami σ identici.
Per semplificare nella rappresentazione degli orbitali atomici sp3 i lobi minori sono omessi.