5. I legami doppi del carbonio
Una seconda modalità utilizzata dal carbonio per formare quattro legami covalenti, è quella di legare due atomi attraverso due legami singoli ed un terzo atomo (che può essere un atomo di carbonio, un ossigeno o un azoto) attraverso un legame doppio.
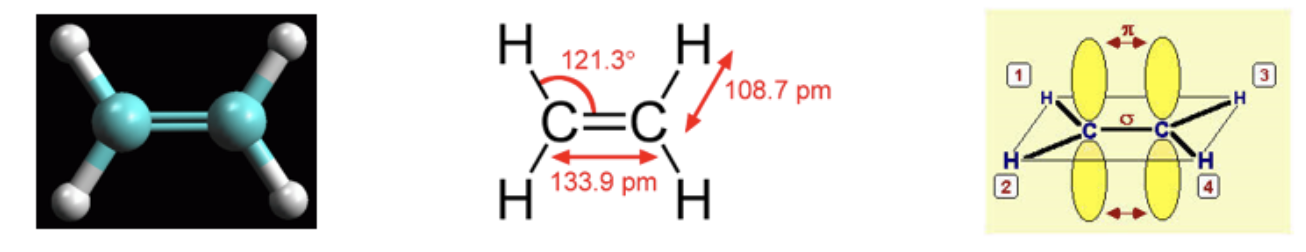
La molecola più semplice in cui riconosciamo questa situazione è l’etene (comunemente noto come etilene), in cui troviamo un carbonio legato, con due legami singoli di tipo σ, a due atomi di idrogeno e, con un legame doppio, di cui il primo di tipo σ e il secondo di tipo π, ad un altro atomo di carbonio. Sperimentalmente si è osservato che i tre legami di tipo σ giacciono su uno stesso piano mentre il quarto legame, di tipo π si trova indifferentemente al di sopra o al di sotto di tale piano.
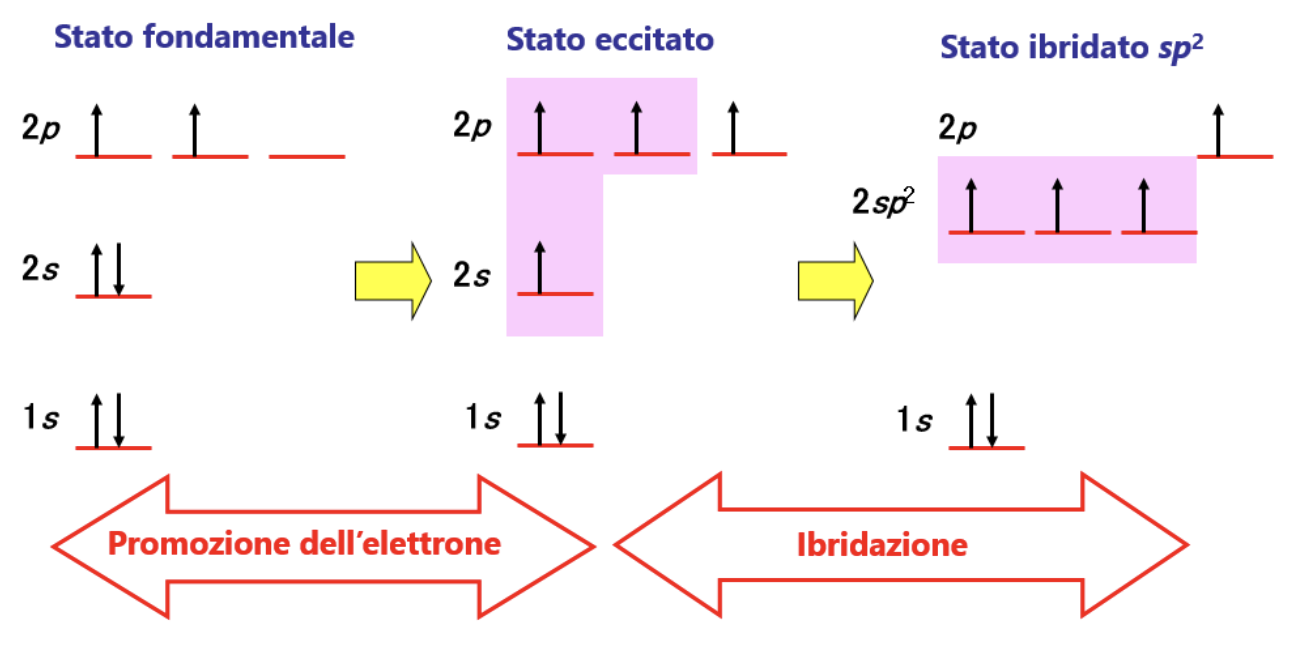
Per spiegare questa evidenza sperimentale si teorizza una seconda modalità di ibridazione. Ancora una volta si assume che il carbonio “ibridi” i suoi orbitali esterni differenti per numero di elettroni ospitati, forma ed energia (stato fondamentale), trasferendo un elettrone dall’orbitale 2s all’orbitale 2pz vuoto (stato eccitato) e ridistribuendo 3 dei 4 elettroni spaiati che così ottiene in 3 orbitali atomici identici per forma ed energia (3 orbitali atomici sp2) e lasciando un elettrone in un orbitale p (ad energia leggermente superiore). Nella figura è illustrato il processo di ibridazione sp2 descritto.