Completion requirements
View
6. Ibridazione sp2 degli orbitali e geometria spaziale
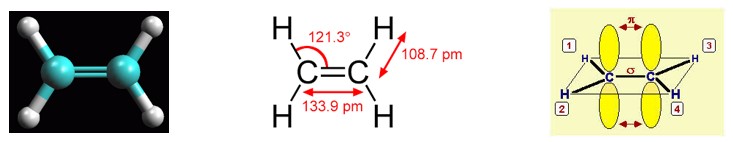
Gli orbitali atomici utilizzati dagli atomi nella formazione dei legami determinano la geometria spaziale della molecola. L’angolo di legame del carbonio ibridato sp2 è 120° .
Il carbonio si dispone al centro ed i tre atomi legati ai vertici di un triangolo equilatero (geometria trigonale planare). Tale disposizione spaziale è quella che garantisce la massima distanza e quindi la minor repulsione elettronica degli elettroni di legame che si trovano in orbitali sp2 (teoria VSEPR). Il quarto elettrone utilizzato per formare il quarto legame, si trova in un orbitale atomico, p, perpendicolare al piano degli orbitali sp2 e che presenta un lobo al di sopra e uno al di sotto di tale piano.
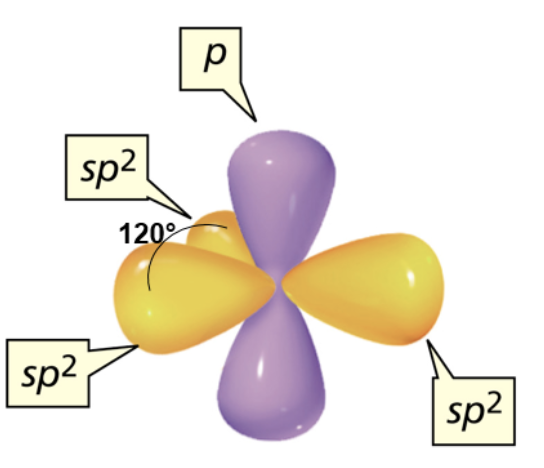
La forma degli orbitali atomici sp2 è simile a quella riportata precedentemente per gli orbitali sp3
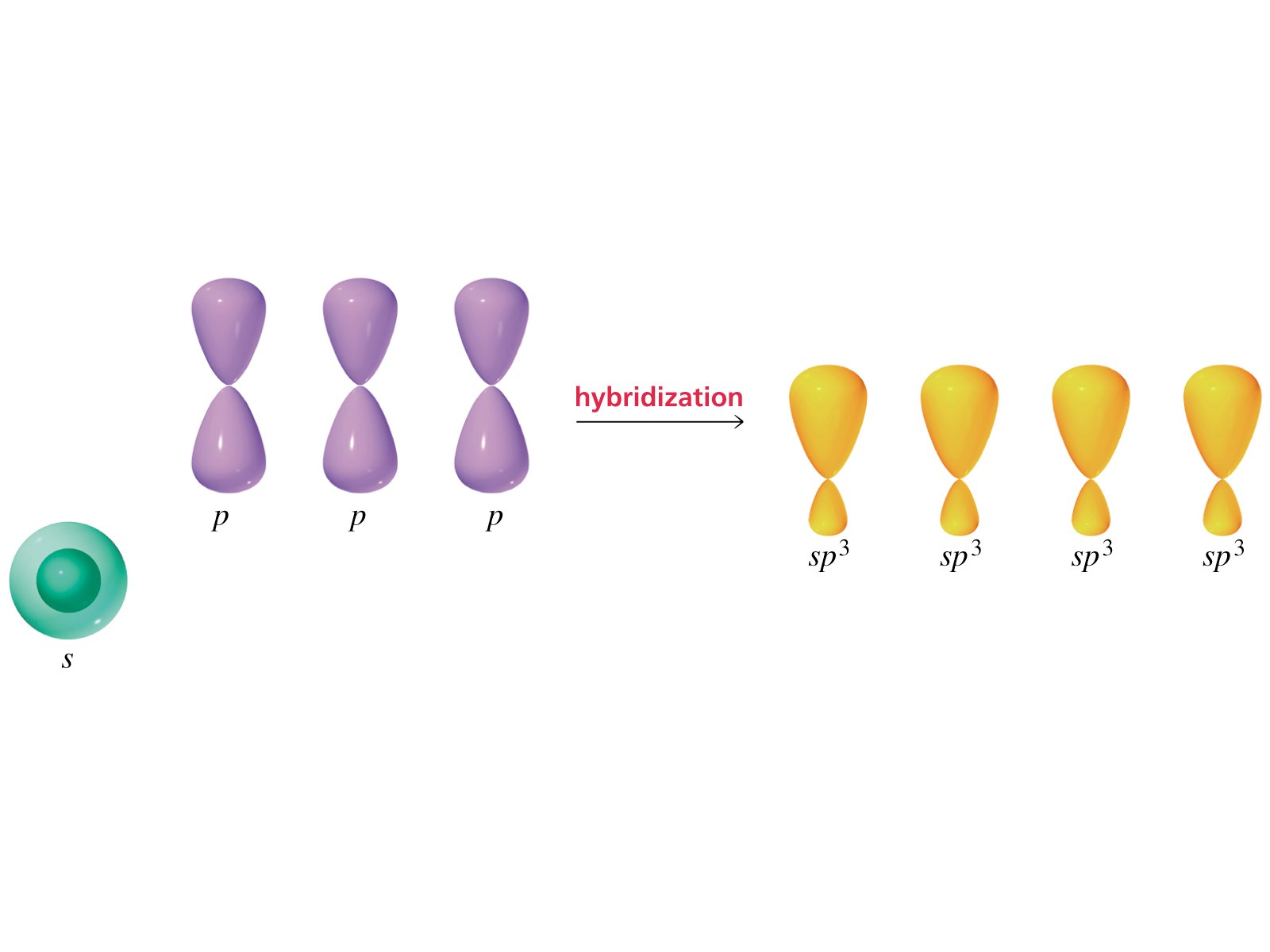
Anche in questo caso nella rappresentazione i lobi minori sono omessi.
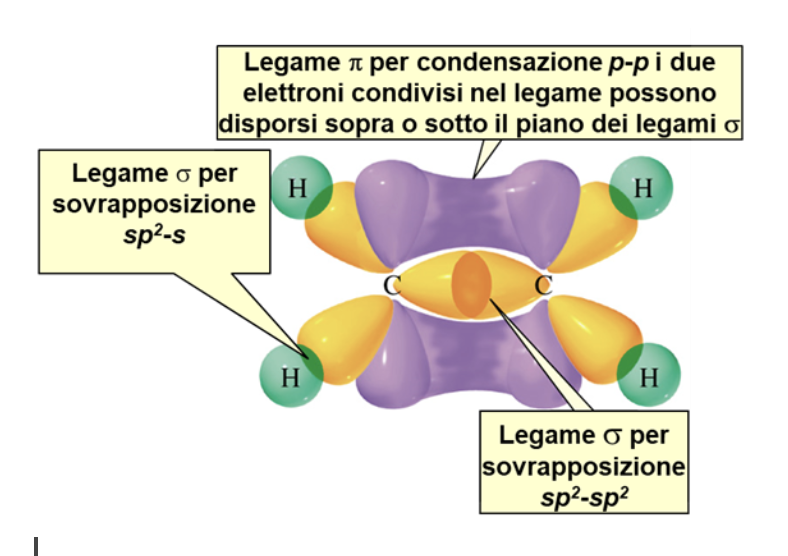
Ciascun carbonio nell’etene forma tre legami σ in un piano e un legame π sopra e sotto tale piano. I sei atomi che costituiscono l’etene (2 carboni, C, e 4 idrogeni, H) si trovano tutti in uno stesso piano.
Il doppio legame C-C consiste di un legame σ (formato dalla sovrapposizione di due orbitali atomici sp2) e un legame π (formato dalla condensazione di due orbitali atomici p).