7. legami tripli del carbonio
Una terza, ed ultima, modalità utilizzata dal carbonio per formare quattro legami covalenti, è quella di legare un atomo attraverso un legame singolo ed un secondo atomo (che può essere un atomo di carbonio, o un azoto) attraverso un legame triplo.
La molecola più semplice in cui riconosciamo questa situazione è l’etino (comunemente noto come acetilene), in cui troviamo ciascun carbonio legato, con un legame singolo di tipo σ, ad un atomo di idrogeno e, con un legame triplo, di cui il primo di tipo σ, mentre il secondo e il terzo di tipo π, ad un altro atomo di carbonio. Sperimentalmente si è osservato che i due legami di tipo σ giacciono su una stessa retta (asse x) mentre i due legami di tipo π si creano rispettivamente sull’asse y e sull’asse z perpendicolari tra loro e rispetto alla retta su cui giacciono i legami σ.
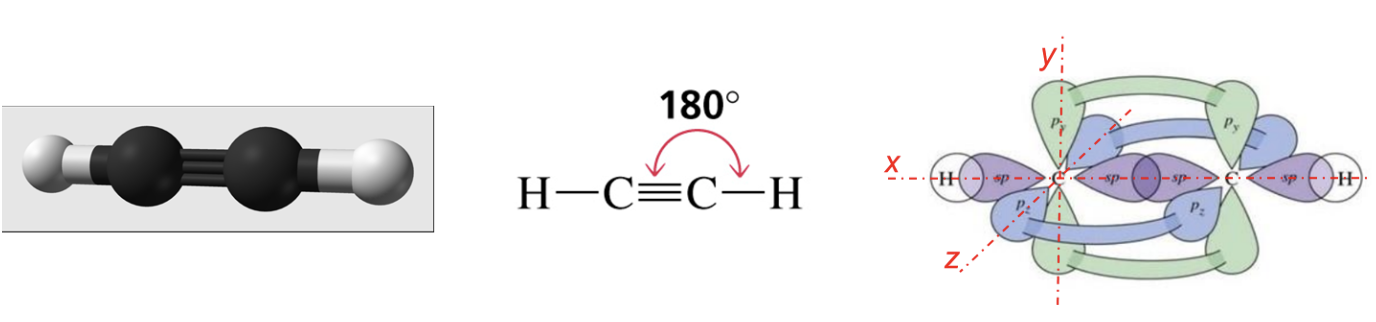
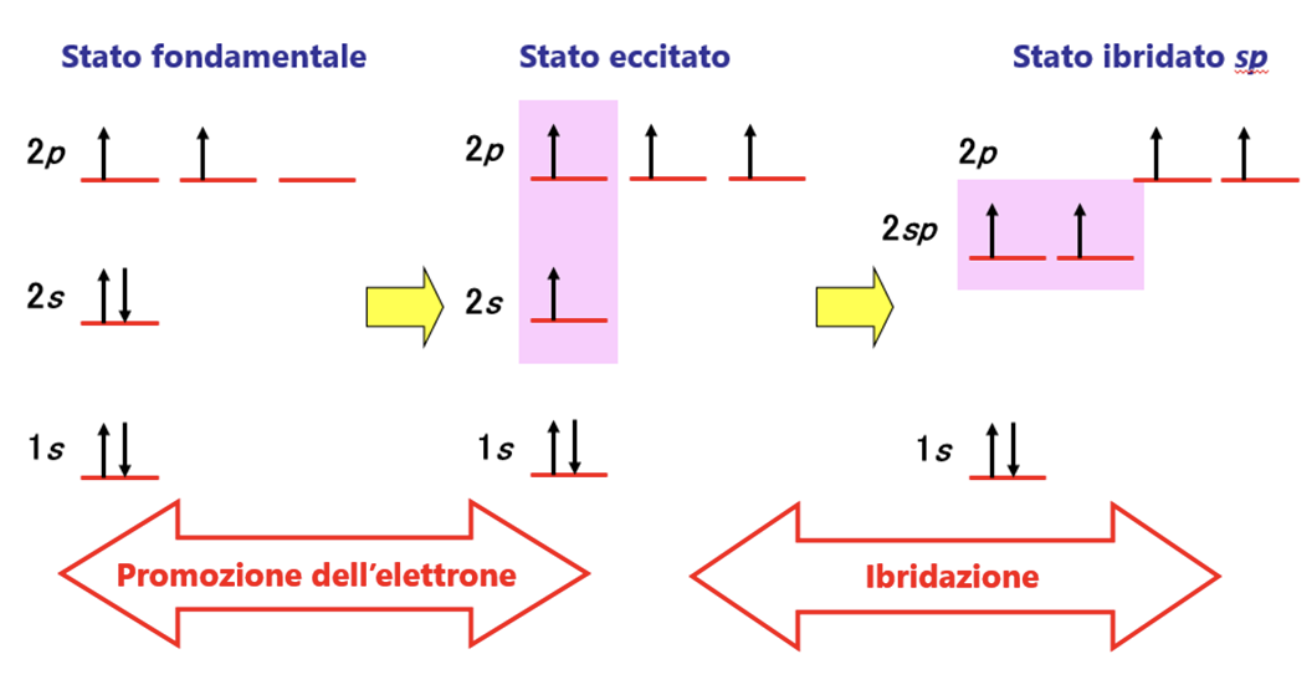
Per spiegare questa evidenza sperimentale si teorizza una terza modalità di ibridazione. Ancora una volta si assume che il carbonio “ibridi” i suoi orbitali esterni differenti per numero di elettroni ospitati, forma ed energia (stato fondamentale), trasferendo un elettrone dall’orbitale 2s all’orbitale 2pz vuoto (stato eccitato) e ridistribuendo 2 dei 4 elettroni spaiati che così ottiene in 2 orbitali atomici identici per forma ed energia (2 orbitali atomici sp) e lasciando gli altri 2 elettroni in due orbitali p (ad energia leggermente superiore). Nella figura è illustrato il processo di ibridazione sopra descritto.