8. Ibridazione sp degli orbitali e geometria spaziale
Gli orbitali atomici utilizzati dagli atomi nella formazione dei legami determinano la geometria spaziale della molecola. Un carbonio ibridato sp dispone due elettroni in orbitali atomici sp che puntano in direzioni opposte, e i due elettroni rimanenti in orbitali atomici, p, perpendicolari tra loro ed alla retta degli orbitali sp.
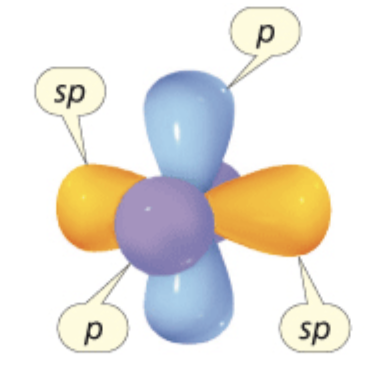
Nella rappresentazione i lobi minori degli orbitali sp sono omessi.
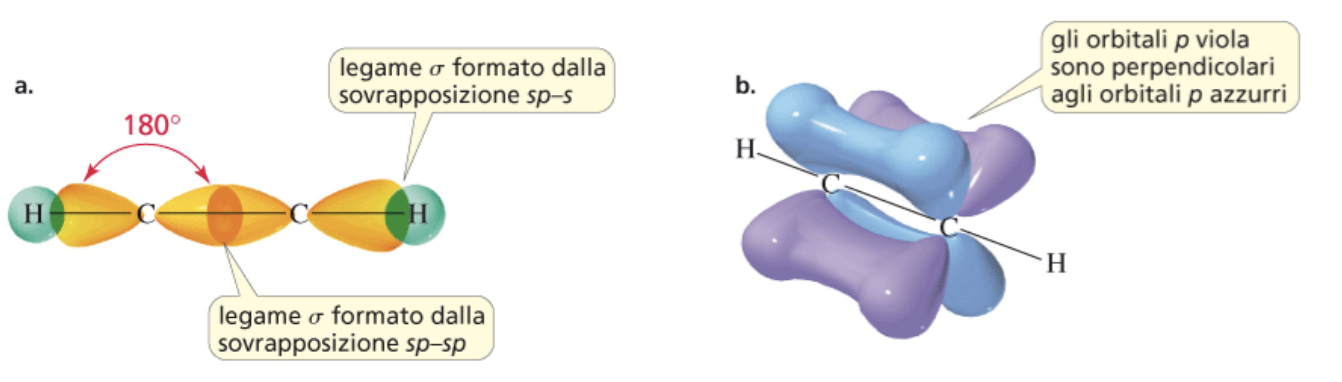
L’angolo di legame del carbonio ibridato sp è 180°. Il carbonio si dispone al centro e i due atomi con cui si lega agli estremi di un segmento (geometria lineare). Tale disposizione spaziale è quella che garantisce la massima distanza e quindi la minor repulsione elettronica degli elettroni di legame che si trovano in orbitali sp (teoria VSEPR).
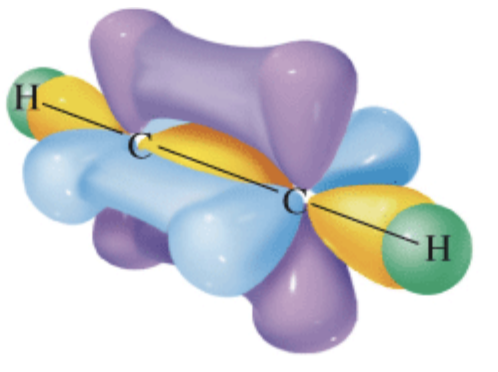
Nell’etino un orbitale atomico sp di un carbonio condensa con un orbitale atomico sp dell’altro carbonio per dare un legame, o orbitale molecolare, di tipo σ. Il restante orbitale atomico sp dello stesso carbonio forma un altro legame σ con l’orbitale s dell’idrogeno disposto dalla parte opposta (figura a). I due legami π si formano per condensazione laterale dei due orbitali atomici px e dei due orbitali atomici py dei due carboni