9. Riassumendo
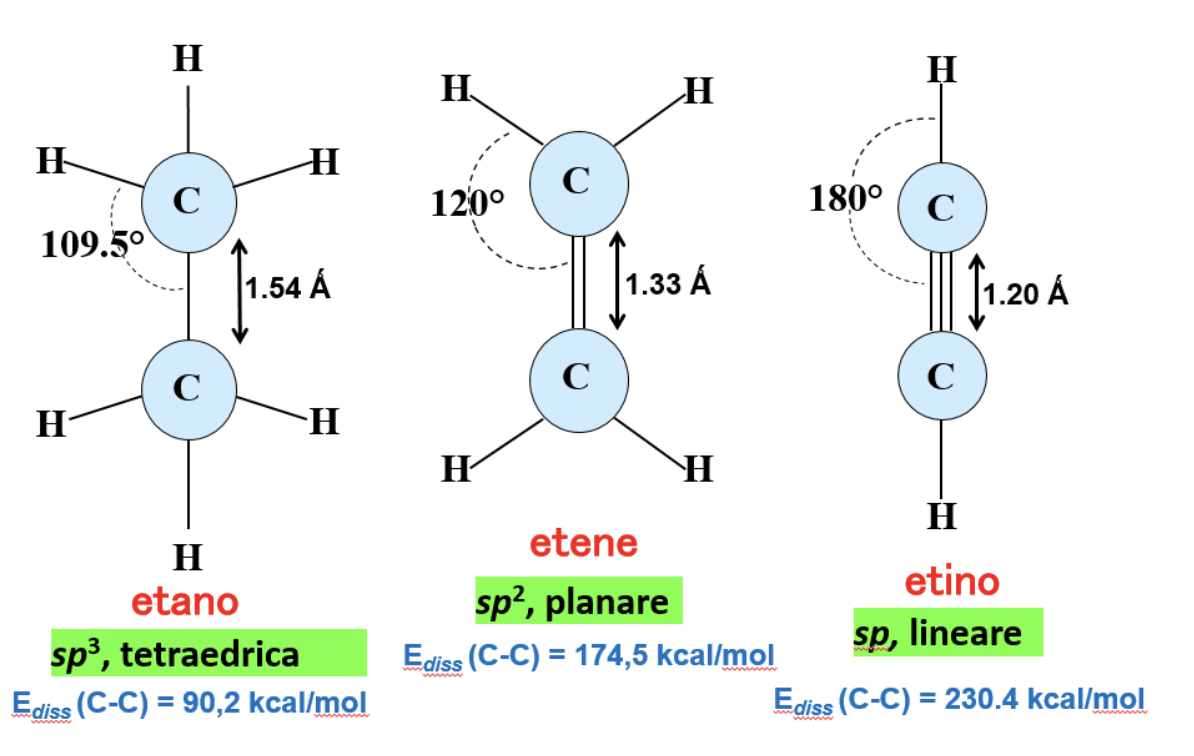
Nella figura sono riassunte e confrontate le caratteristiche dei tre possibili stati di ibridazione del carbonio.
Un carbonio ibridato sp3 presenta geometria tetraedrica e angoli di legame pari a 109.5°.
Un carbonio ibridato sp2 presenta geometria trigonale planare e angoli di legame di 120°.
Un carbonio ibridato sp presenta geometria lineare e angoli di legame pari a 180°.
La distanza, in figura espressa in Ångström (1 Å = 1x10-10 m = 0.1 nm) tra due carboni ibridati sp è minore della distanza tra due carboni ibridati sp2, che a sua volta è minore della distanza tra due carboni sp3. Al diminuire della distanza aumenta la forza del legame. Un legame σ ottenuto per sovrapposizione di due orbitali atomici sp è più corto e più forte di un legame σ ottenuto per sovrapposizione di orbitali atomici sp2, che a sua volta è più corto e più forte di quello ottenuto per sovrapposizione di due orbitali atomici sp3.
L’energia necessaria a separare due carboni legati, energia di dissociazione di legame (Ediss (C-C)) in figura espressa in kcal/mol (1 kcal = 4.18 kJ) aumenta a seconda che i due carboni siano legati con legame singolo, doppio o triplo. Per rompere un triplo legame occorre ovviamente più energia rispetto a quella necessaria a rompere un legame doppio, a sua volta superiore a quella necessaria a rompere un legame singolo. Il primo legame π è leggermente più facile a rompersi del secondo, che a sua volta è significativamente più facile a rompersi del legame σ.
