10. Grafite e diamante
La differenza che può fare l’ibridazione è illustrata dal diamante e dalla grafite, che appaiono molto diversi, ma sono due forme dello stesso elemento: il Carbonio.
La grafite presenta atomi di carbonio ibridati sp2 disposti secondo maglie esagonali su piani legati da forze assai deboli.
Il diamante è caratterizzato da una struttura assai compatta con intense forze di attrazione tra gli atomi di carbonio ibridati sp3. Ciascun atomo di carbonio è legato covalentemente ad altri quattro atomi di carbonio. Ogni diamante è quindi una molecola unica (solido covalente) costituita da un enorme numero di atomi di carbonio distanti 0,154 nm l'uno dall'altro.
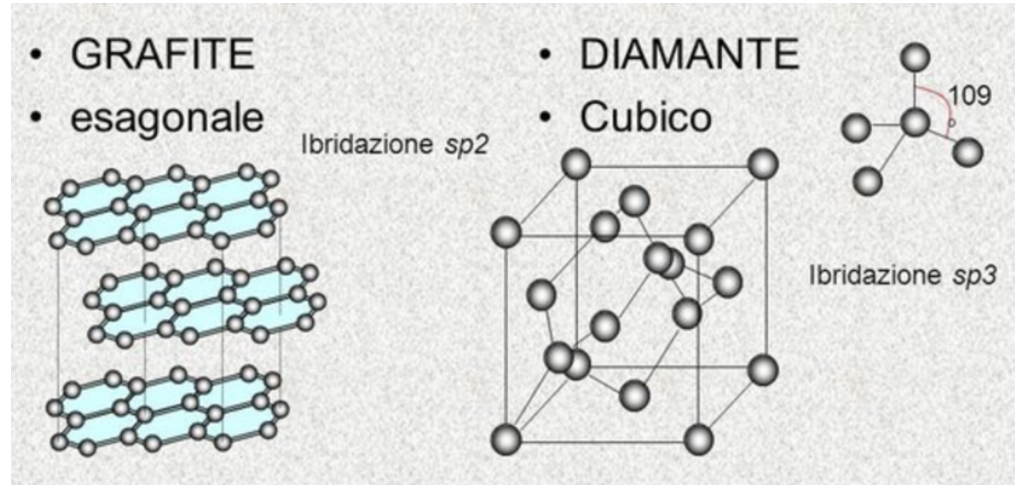
Il debole legame tra gli strati di atomi nella grafite, giustifica l’estrema facilità con cui questo materiale si sfalda (si pensi alla mina della matita, dove scrivendo non si fa altro che lasciare strati di grafite sul foglio).

Viceversa, l’energia necessaria a rompere i legami tra gli atomi di carbonio nel diamante risulta essere molto elevata, tant’è che tale materiale presenta un’elevatissima temperatura di fusione ed una straordinaria durezza: per sfaccettare un diamante, infatti, è necessario usare un altro diamante.

