Aggregazione dei criteri
Visualizzare
5. Come si riconosce un composto ionico

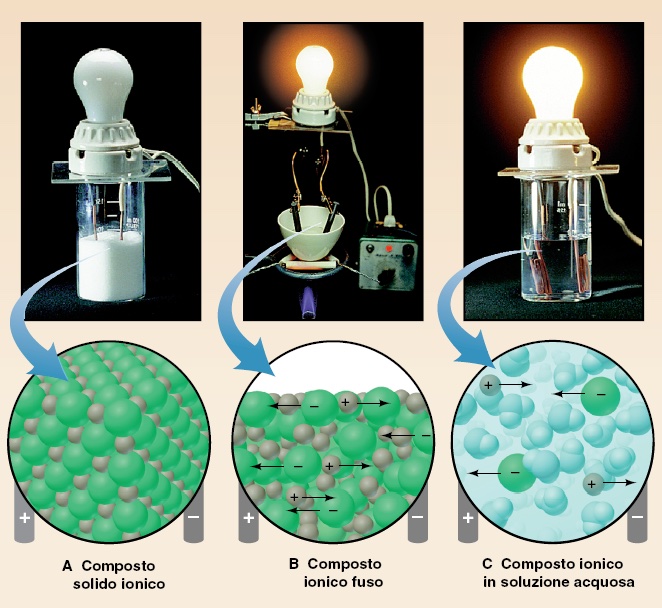
Quindi le caratteristiche che contraddistinguono un composto ionico sono:
- Cristalli ben formati, con facce, spigoli, vertici netti (spesso la forma richiama la disposizione degli atomi a livello microscopico);
- Alti punti di fusione (sono necessarie altissime temperature per vincere le attrazioni elettrostatiche tra gli ioni e permettere agli ioni di spostarsi dalle posizioni reticolari);
- Conducibilità allo stato fuso (una volta liberi di muoversi, gli ioni possono muoversi e trasportare carica);
- Conducibilità in soluzione (gli ioni persistono anche in soluzione, anche se circondati dalle molecole di solvente);
- Duri ma fragili (occorre uno stress intenso per staccare gli atomi, ma una volta formata la frattura, questa si propaga a tutto il cristallo e non c’è modo di ricomporre le due facce).
