8. Forza di acidi e basi /1
Domanda: tutte le reazioni chimiche acido-base sono incomplete (equilibri) come quella di autoprotolisi dell’acqua?
Risposta: NO!
A seconda del tipo di acido e di base che reagiscono, la reazione può essere completa o di equilibrio e, nel secondo caso, con costanti di equilibrio che possono avere valori da molto grandi a molto piccoli.
Domanda: come possiamo dunque confrontare il comportamento degli acidi (o delle basi) tra loro?
Risposta: costruendo una scala di confronto!!
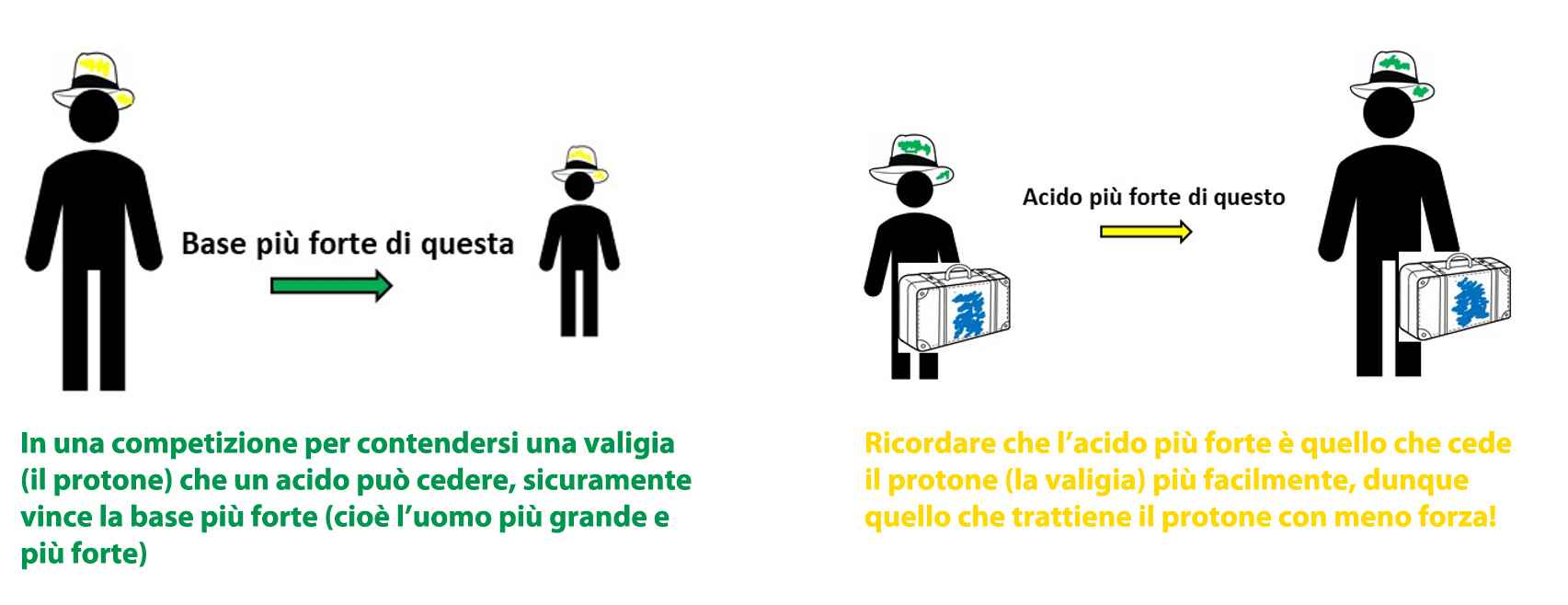
Prima di tutto bisogna definire un termine che ci permetta il confronto quantitativo: chiamiamo FORZA di un acido (o di una base) la sua tendenza a cedere il protone ad una base (o di una base a prendere il protone).
L’acido è tanto più forte tanto più facilmente cede il protone ad una base.
Analogo discorso, ma opposto, vale naturalmente per le basi! Dunque, la quantità di prodotti formati in una reazione acido-base dipende sia dalla forza dell’acido sia da quella della base reagenti.
Ricordiamo il nostro scopo: predisporre una scala di forza per gli acidi e le basi.
Metodo e requisiti: prendere una base di riferimento per gli acidi e fare reagire tutti con la stessa base e un acido di riferimento per le basi e fare reagire tutte con lo stesso acido. In questo modo si avrà una scala quantitativa e confrontabile, anche se relativa al riferimento: la forza di un acido o di una base può essere misurata in base al valore della costante di equilibrio.
A parità di base, più forte è l’acido usato, maggiore è il valore di Keq
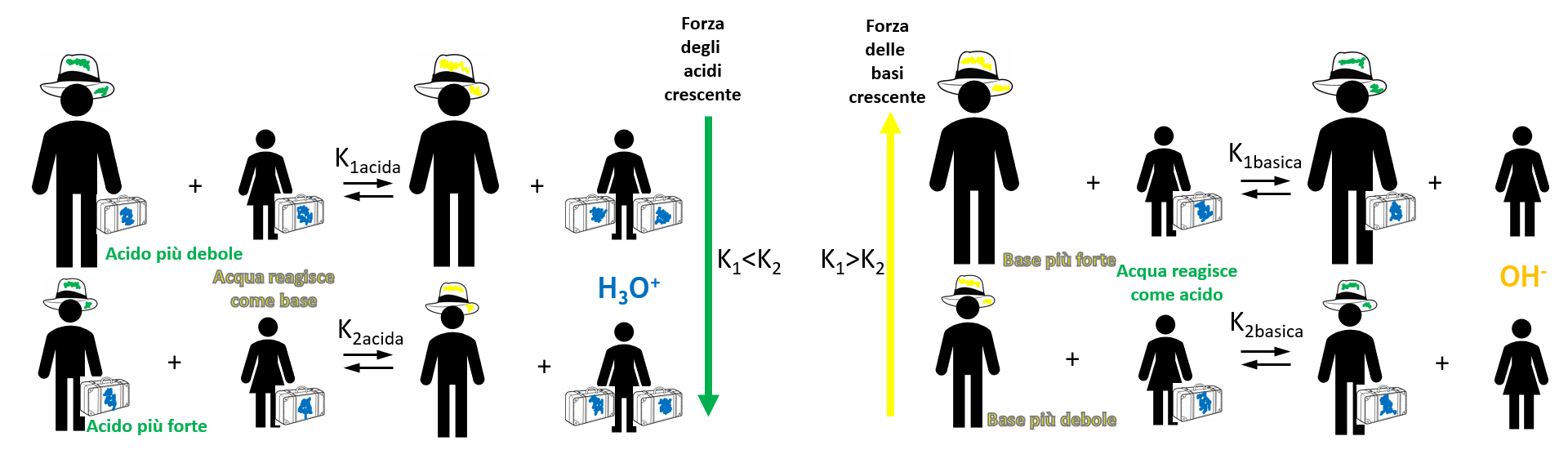
Come riferimento, sia come base che come acido è stata presa l’acqua (che essendo anfiprotica si può comportare sia da acido con le basi che da base con gli acidi) ed è stata fatta una scala di forza.
