3. Bilanciamento degli Schemi di Reazione
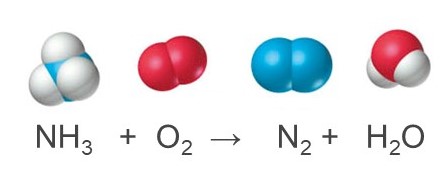
nelle condizioni “finali” il recipiente dovrebbe contenere 2 atomi di azoto (1 molecola di N2), nonché 2 di idrogeno e 1 di ossigeno (1 molecola di H2O). La natura di reagenti e prodotti è ben descritta, ma lo schema di reazione non tiene correttamente conto del rapporto di combinazione tra le molecole di reagenti, né di quello di formazione dei rispettivi prodotti, dando una reazione non bilanciata.
Bilanciare una reazione significa individuare i valori numerici dei coefficienti stechiometrici, indicati con i simboli generici a, b, … m, n, … affinché il numero di atomi di ciascun elemento rimanga invariato nella conversione dei reagenti in prodotti.
a A + b B + … → m M + n N + …
Per esempio, con riferimento alla reazione tra ammoniaca e ossigeno a dare azoto e acqua, si può facilmente verificare che l’impiego dei seguenti coefficienti stechiometrici: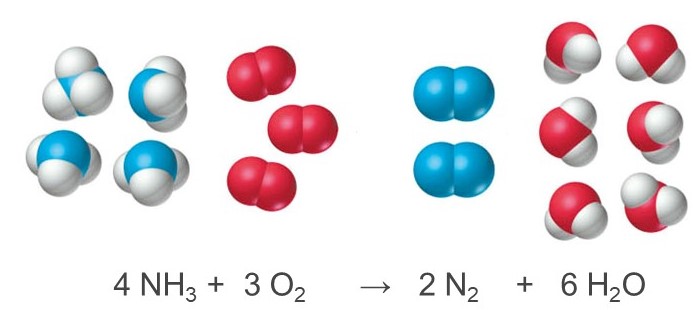
conduce a una reazione bilanciata. Queste semplici relazioni numeriche (ad esempio, NH3 e O2 reagiscono in rapporto 4:3, N2 si forma con un rapporto 2:3 rispetto a O2) non sono valide se esprimiamo le quantità di reagenti e prodotti in massa (per esempio, in grammi o in chilogrammi).
