5. La legge cinetica: effetto della concentrazione sulla velocità di reazione /2
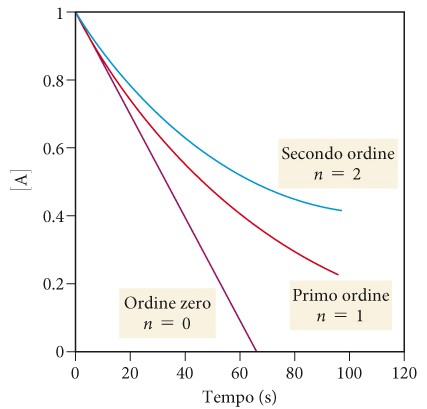
Il valore di n (di solito un numero intero) determina il modo in cui la velocità dipende dalla concentrazione del reagente nella equazione cinetica v=k[A]n per la reazione A che da 2B
Se n=0, la reazione è di ordine zero e la velocità è indipendente dalla concentrazione di A (la concentrazione del reagente diminuisce linearmente nel tempo).
Appartengono a questa categoria molte reazioni catalizzate da enzimi
Se n=1, la reazione è del primo ordine e la velocità è direttamente proporzionale alla concentrazione di A e diminuisce al procedere della reazione perché la concentrazione del reagente diminuisce. Una importante reazione del primo ordine è la scissione del saccarosio (comune zucchero da cucina) in glucosio e fruttosio.
Se n=2, la reazione è del secondo ordine e la velocità è proporzionale al quadrato della concentrazione di A di conseguenza, la velocità è ancora più sensibile alla concentrazione del reagente rispetto a una del primo ordine.
Se consideriamo questa generica reazione: aA + bB → cC + dD
Fino a quando la reazione inversa è trascurabile, la legge cinetica è proporzionale al prodotto della concentrazione di A, elevata a m, per la concentrazione di B, elevata a n: in cui m è l'ordine della reazione rispetto ad A e n è l'ordine di reazione rispetto a B. L'ordine totale è la somma degli esponenti (m + n).
