7. Effetto della temperatura sulla velocità di reazione
L’esperienza pratica suggerisce che le reazioni siano più veloci con l’aumento della temperatura infatti partendo dalla temperatura ambiente, un aumento della temperatura di 100° C può far aumentare la velocità di una reazione di uno o due ordini di grandezza.
La dipendenza dalla temperatura della velocità della reazione è contenuta nella costante di velocità, k (che è realmente una costante solo quando la temperatura rimane costante). Un aumento della temperatura generalmente porta ad un aumento della k, e di conseguenza ad una velocità maggiore.
Il chimico svedese Svante Arrhenius nel 1889 scrisse un’equazione che porta il suo nome in cui viene mostrata la relazione tra la costante di velocità (k) e la temperatura in kelvin (T):
k = A e-Ea/RT
In questa equazione, R è la costante dei gas (8.314 j K/mol), A è una costante detta fattore di frequenza (o fattore pre-esponenziale), e Ea è l'energia di attivazione (o barriera di attivazione).
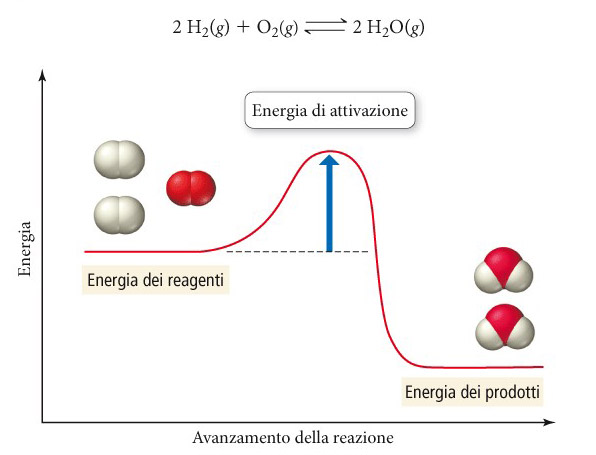
L'equazione ottenuta empiricamente è in accordo con la teoria delle collisioni che enfatizza l'importanza della frequenza delle collisioni molecolari e della necessità di una favorevole orientazione delle molecole nelle collisioni (fattore A) nonché della frazione delle collisioni dotata di sufficiente energia per produrre una reazione (fattore esponenziale).
