Aggregazione dei criteri
Visualizzare
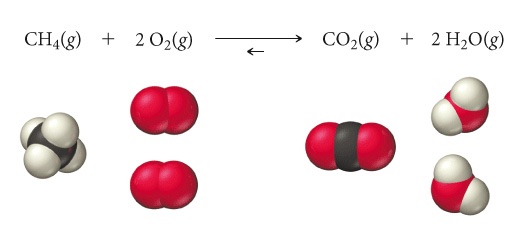
3. Reazione quantitative vs reazioni all’equilibrio
La costante di equilibrio è una misura delle concentrazioni relative di reagenti e prodotti all’equilibrio e quindi del grado di avanzamento di una reazione; più elevata è la costante di equilibrio, maggiore è la concentrazione dei prodotti rispetto a quella dei reagenti all’equilibrio. Generalmente, un valore elevato della costante di equilibrio (Keq>>1) indica che la reazione diretta è ampiamente favorita e che, all’equilibrio, la quantità di prodotto sarà maggiore di quella di reagente. Al contrario, un valore piccolo della costante di equilibrio (Keq<<1) indica che la reazione inversa è favorita e che, all’equilibrio, la concentrazione di reagenti sarà più alta di quella dei prodotti. Portando agli estremi le precedenti affermazioni potremmo considerare le reazioni quantitative come quelle in cui le concentrazioni dei reagenti (o almeno uno, il reagente limitante) sono nulle e si ha la massima conversione dei reagenti della reazione in prodotti, come ad esempio nella reazione di combustione del metano in seguito ad un innesco iniziale. Viceversa se la concentrazione dei prodotti è pari a zero significa che la reazione diretta non avviene nelle condizioni esplicitate. Ad esempio la conversione di anidride carbonica e acqua in metano non avviene spontaneamente anche in presenza di un innesco.