5. Principio di Le Châtelier /1
Il principio di Le Châtelier (o equilibrio mobile) afferma che, quando un sistema chimico all’equilibrio viene perturbato, il sistema si sposta nella direzione che rende minima la perturbazione. In altre parole, un sistema all’equilibrio cerca di mantenere il proprio stato, e si oppone alla perturbazione. Il principio di Le Châtelier consente di prevedere che cosa accade a un sistema chimico all’equilibrio quando le condizioni vengono mutate. Ciò ci permette di modificare le condizioni di una reazione chimica per ottenere un dato risultato. Esistono diversi modi per perturbare un sistema chimico all’equilibrio, il primo che viene in mente è quello di considerare aggiunta/sottrazione di reagenti /prodotti all’/dall’ ambiente di reazione. Consideriamo la seguente reazione in equilibrio chimico:
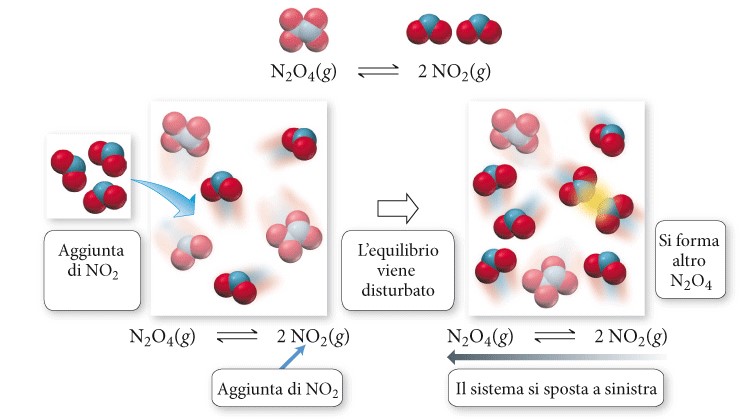
N2O4 (g) ⇄ 2 NO2 (g)
Supponiamo di perturbare l’equilibrio aggiungendo NO2 alla miscela all’equilibrio. In base al principio di Le Châtelier, il sistema si sposta in direzione tale da rendere minima la perturbazione. Lo spostamento è dovuto all’aumento di concentrazione di NO2, che a sua volta determina un aumento della velocità della reazione inversa, dal momento che le velocità di reazione generalmente aumentano con la concentrazione. Per riassumere, se un sistema chimico è all’equilibrio: un aumento della concentrazione di uno o più reagenti provoca lo spostamento della reazione verso destra (in direzione dei prodotti) viceversa un aumento della concentrazione di uno o più prodotti provoca lo spostamento della reazione verso sinistra (in direzione dei reagenti). Analogamente se un sistema chimico è all’equilibrio: una diminuzione della concentrazione di uno o più reagenti provoca lo spostamento della reazione verso sinistra (in direzione dei reagenti) viceversa una diminuzione della concentrazione di uno o più prodotti provoca lo spostamento della reazione verso destra (in direzione dei prodotti).