7. Principio di Le Châtelier /3
Nel caso di reazioni in fase gassosa, occorre ricordare che una variazione del volume di un gas (o di una miscela di gas) dà origine a una variazione della sua pressione (legge dei gas ideali, proporzionalità inversa). Se il volume di una miscela di reazione allo stato aeriforme all’equilibrio chimico cambia, la pressione varia e il sistema si sposterà in direzione tale da rendere minimo il cambiamento. Consideriamo, per esempio, la seguente reazione all’equilibrio, che si svolge all’interno di un cilindro dotato di un pistone mobile: N2(g) + 3 H2(g) ⇄ 2 NH3(g).
Immaginiamo di spingere il pistone verso il basso,
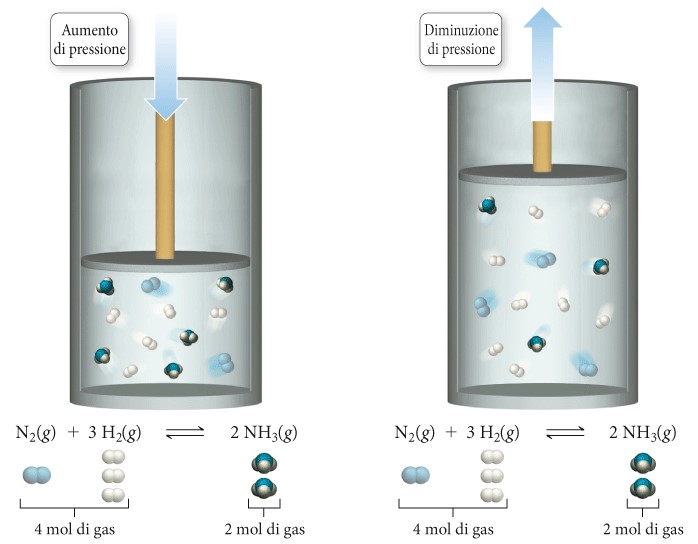
diminuendo così il volume e aumentando la pressione. Se la reazione si sposta verso destra, 4 moli di particelle allo stato aeriforme (1 mole di N2 e 3 moli di H2) si convertono in 2 moli di particelle nello stesso stato (2 moli di NH3). Perciò, con lo spostamento della reazione verso i prodotti, la pressione si abbassa (poiché la miscela contiene un numero inferiore di particelle allo stato aeriforme). Il sistema, quindi, si sposta verso destra, riabbassando la pressione e rendendo minima la perturbazione.
