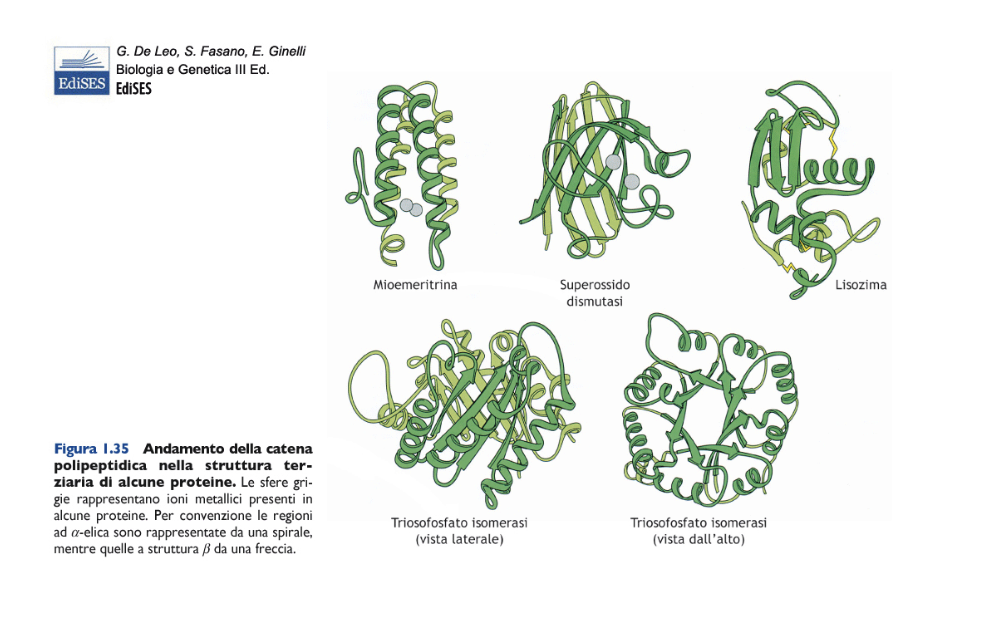
2. Struttura primaria e secondaria
Il prodotto della polimerizzazione degli amminoacidi è un polipeptide, una catena polipeptidica che non ha ancora acquisito l’organizzazione tridimensionale tipica della proteina biologicamente attiva. Le proteine presentano diversi livelli di organizzazione strutturale: struttura primaria, secondaria, terziaria e quaternaria. La struttura primaria è la sequenza lineare degli amminoacidi che compongono la catena polipeptidica, specifica per ogni proteina (Figura A). L’informazione per la disposizione degli amminoacidi nella struttura primaria è contenuta nel genoma, codificata nella sequenza lineare dei nucleotidi del DNA. La struttura secondaria è una conformazione che riguarda segmenti della catena polipeptidica. Esistono due tipi di struttura secondaria: alfa-elica e piano o foglietto beta (Figura B).
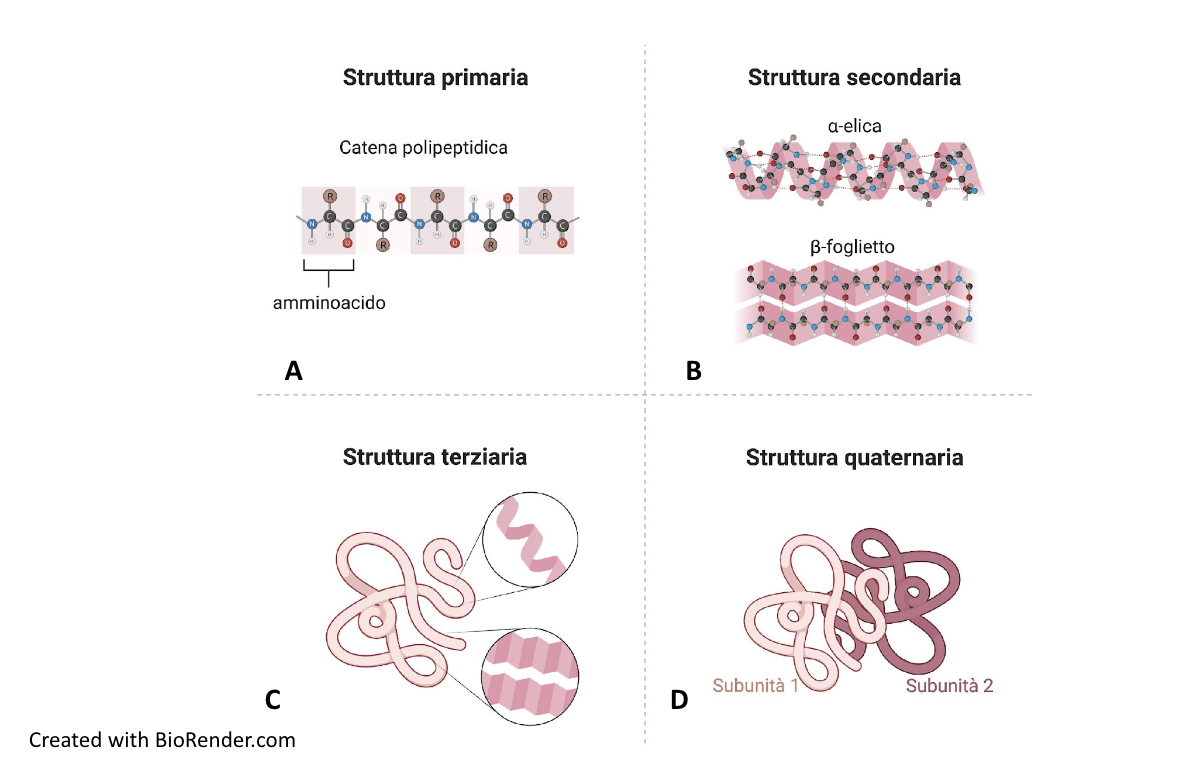
L’alfa-elica consiste in un ripiegamento elicoidale della catena, mentre il foglietto beta si realizza quando parti della catena si allineano a formare un piano pieghettato. Le due conformazioni sono stabilizzate da legami a idrogeno che si formano tra i legami peptidici di amminoacidi situati a diversa distanza lungo la catena. Nell’alfa-elica i gruppi R degli amminoacidi sporgono verso l’esterno dall’asse longitudinale dell’elica, mentre nel piano-beta i gruppi R sporgono alternativamente al di sopra o al di sotto del piano. L’alfa-elica e il piano beta sono conformazioni rigide per l’elevato numero di legami a idrogeno che si formano tra i gruppi peptidici. In molte proteine, le due conformazioni sono entrambi presenti, separate da anse o giri che conferiscono flessibilità alla catena stessa.