Aggregazione dei criteri
Visualizzare
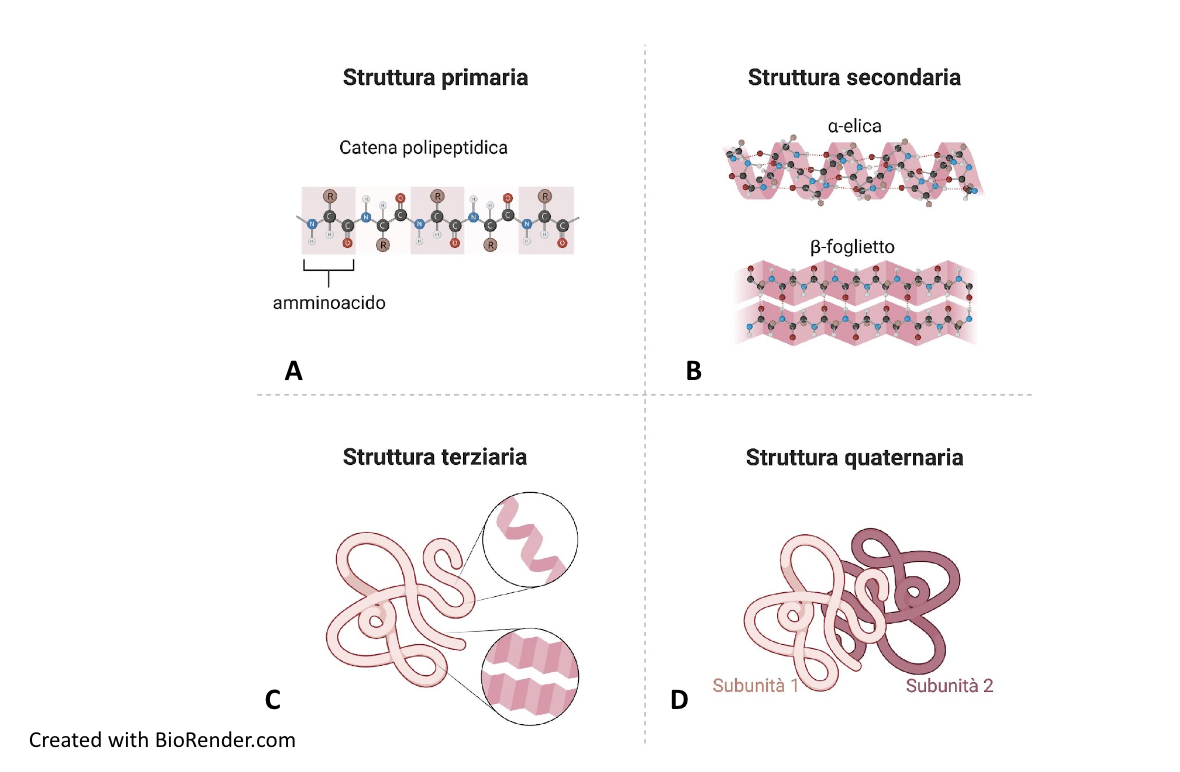
3. Struttura terziaria e quaternaria
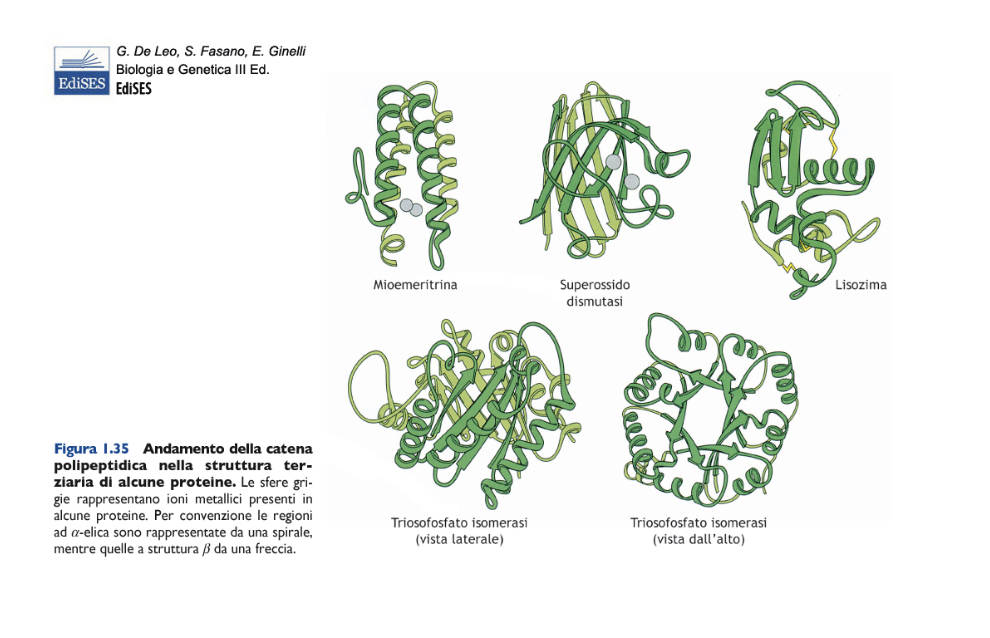
La struttura terziaria consiste nel ripiegamento tridimensionale dell’intera catena polipeptidica (Figure C e 1.35) e corrisponde allo stato nativo della proteina, ossia alla sua conformazione funzionale.
 |
 |
|---|
Molte proteine assumono una forma compatta e si definiscono proteine globulari, altre presentano una forma distesa e si chiamano proteine fibrose. Esiste però un’enorme varietà di strutture terziarie, solo in parte ricostruite tramite le tecniche di cristallografia a raggi X o di risonanza magnetica nucleare, da cui è possibile ricavare la posizione di tutti gli atomi nella molecola proteica. La struttura terziaria è stabile ma dinamica, cioè può subire cambiamenti interni, detti modificazioni conformazionali, da cui dipende la funzione della proteina.
Molte proteine sono costituite da più catene polipeptidiche, uguali o diverse tra loro, che definiscono la struttura quaternaria della proteina (Figura D). I polipeptidi sono subunità della singola molecola proteica che solo unitariamente svolge la sua specifica funzione.
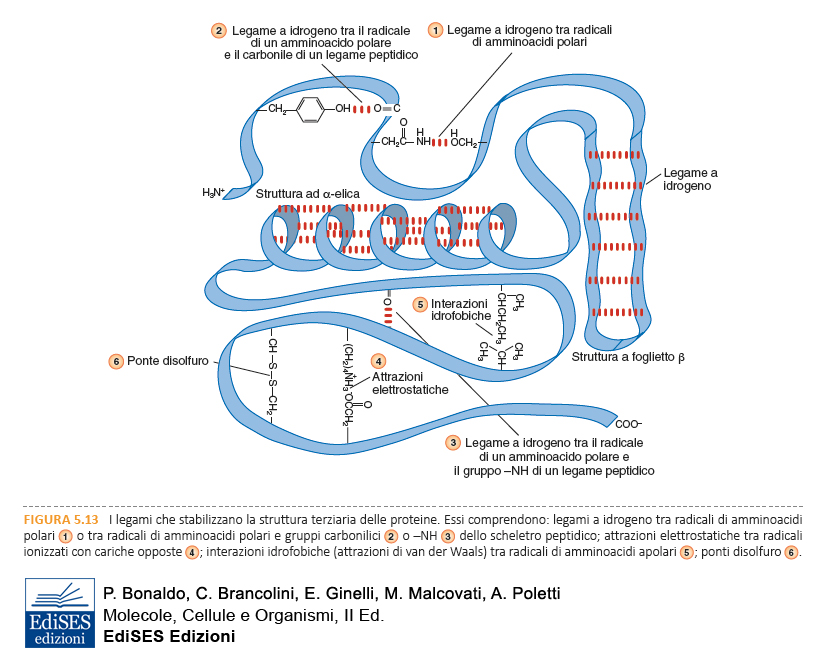
Struttura terziaria e struttura quaternaria sono stabilizzate da un gran numero di legami deboli e interazioni che si stabiliscono tra le catene laterali degli amminoacidi e tra questi e le molecole di acqua.
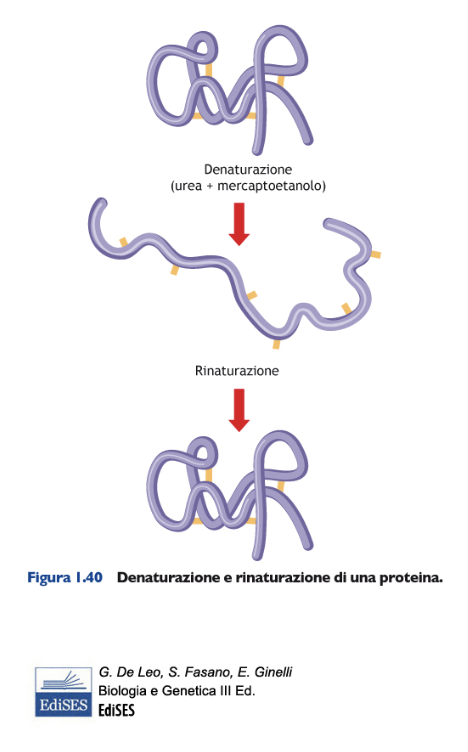
La rottura di tutti i legami deboli e dei ponti disolfuro con agenti denaturanti, come urea e mercaptoetanolo, provoca la perdita della conformazione nativa e della funzione della proteina, ossia la denaturazione della proteina stessa, che assume un’organizzazione spaziale distesa. Dopo la rimozione degli agenti denaturanti, la proteina può riavvolgersi spontaneamente (rinaturazione) riacquistando la propria attività funzionale.